经典的肿瘤坏死因子抑制剂们
依那西普是由两个可溶的p75 TNF受体融合至人IgG1的Fc部分形成的二聚体形式的融合蛋白,其能够通过结合肿瘤坏死因子(Tumor necrosis factor,TNF),并抑制TNF与其受体的结合而治疗自身免疫性疾病。依那西普与之前我们介绍过的“药王”阿达木单抗的关键区别在于,依那西普除了能够结合TNF-α之外,还能够结合LT-α(即TNF-β)。LT-α是与TNF-α结构同源的细胞因子,能够介导与TNF-α类似的炎症过程。
Enbrel®于1998年11月被FDA首次批准用于治疗多发性硬化症。之后,FDA陆续批准的适应症还包括青少年类风湿关节炎(1999年5月27日)、银屑病关节炎(2002年1月18日)、中重度斑块状银屑病(2004年4月30日)和强直性脊柱炎(2003年7月24日)。2010年,Enbrel®登陆中国市场,已被批准的适应症包括类风湿关节炎和强直性脊柱炎。
Enbrel®的给药方式为皮下注射,包括三种制剂形式,分别为:25mg冻干瓶装剂型、预灌装的注射器剂型和预灌装SureClick自主注射器剂型,其中第三种剂型给药最为方便。
商业推广方面,Enbrel®最早是由Immunex与Wyeth-Ayerst(简称为惠氏)共同进行开发和商业化的。2002年,鉴于Enbrel®巨大的市场潜力,安进以大约160亿美元将Immunex收购,而2009年,辉瑞收购惠氏为其旗下子公司。此后,安进负责Enbrel®在美国和加拿大市场的销售,而辉瑞负责Enbrel®在美国和加拿大以外地区的销售。
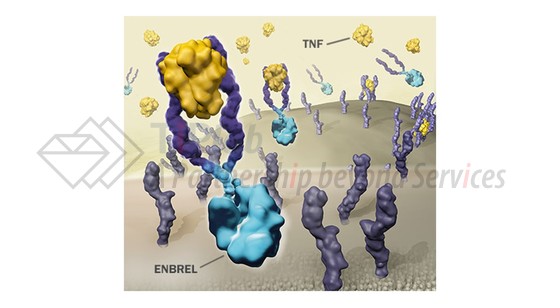
鉴于其较复杂的权属关系以及巨大的商业价值,围绕Enbrel®的专利保护显得相当复杂,下面就让我们一起探讨一下原研药企业为了延长该产品的生命周期而构筑的重重专利壁垒。
保护Enbrel®的专利壁垒
美国
1994年,Immunex递交了第一个保护依那西普的核心专利申请并获得授权(US5712155),该专利保护编码融合蛋白的DNA分子。1995年,Immunex针对使用融合蛋白降低TNF-α水平的方法递交了专利申请并获得了授权(US5605690)。对于Enbrel®的仿制药企业来说,这两个核心专利基本上无法绕过,不过US5712155已经于2012年到期,而US5605690也已于2014年届满失效。
作为“专利防护网”的第二层保护,2007年,Immunex递交了涉及蛋白制剂的专利申请并获得了授权(US7648702),具体保护融合蛋白的稳定液体制剂,其保护期至2023年2月27日。值得注意的是,这个专利虽然能够阻止竞争对手生产类似的液体制剂,却不涵盖融合蛋白的冻干剂型,而冻干剂型正是Enbrel®上市销售的重要剂型之一。换言之,因为US7648702无法阻止他人生产冻干剂型,因此并不能全面地保护Enbrel®这一产品。
2009年,Immunex递交了US7648702的分案申请并获得了授权(US8119604),该专利保护使用融合蛋白的稳定液体制剂治疗哺乳动物类风湿性关节炎、银屑病关节炎、强直性脊柱炎和/或银屑病的方法,其保护期至2023年6月8日。值得一提的是,US8119604也不涉及使用冻干制剂的治疗方法,因此没能弥补其母案US7648702在保护方面的不足。
2009年至2013年间,针对不同的具体适应症,Immunex还递交了若干涉及治疗方法的专利申请,并陆续获得了授权,例如US7915225,及其延续案和分案US8119605、US8410060以及US8722631。其中,US7915225保护依那西普在治疗银屑病和银屑病关节炎中的应用,US8119605保护使用依那西普治疗银屑病的方法,US8410060保护使用依那西普治疗银屑病关节炎的方法,而US8722631保护使用依那西普治疗银屑病关节炎和斑块性银屑病的方法,这四个专利都将于2019年8月13日到期。
到此为止,Enbrel®的专利保护策略似乎并没有太多超出常规的“意外惊喜”,直到我们看到2011年11月22日在USPTO获得授权的专利US8063182,和2012年4月24日获得授权的专利US8163522。这不是两个普通的美国专利,而是传说中的“潜水艇”专利(submarine patent),它们的申请日为1995年5月19日,而优先权日更早至1989年9月12日(因为分案的缘故)。所谓“潜水艇”专利,是指1995年6月8日美国专利法更改以前递交的专利申请,其因为一些事件而导致授权延迟。这些专利在授权前一直处于保密状态,直至授权时才突然公开,因此称之为潜水艇专利。这些专利的保护期为授权日起17年,由于授权很晚,就导致其到期日也相应较晚。因为1)授权前不公开以及2)到期日很晚,使得这些“潜水艇”专利杀伤力极强。
那么,这两个秘密武器是缘何而来的呢?实际上,这两个重磅武器并不是原研药厂自己“制造”的,而是“买买买”获得的。故事要追溯到将近20年之前。1995年5月19日,罗氏递交了针对依那西普的两个专利申请,而安进在得知这个消息之后决定从罗氏获得这两个专利的许可,分别经过了长达16年和17年后,US8063182和US8163522终于获得了授权。其中,US8063182保护融合蛋白的结构,其中没有限定TNF结合结构域的具体序列,保护范围比较宽泛且难以规避,给竞争对手的产品上市造成了巨大障碍,而且从授权日2011年11月22日起算加上17年,这个专利要到2028年11月22日才到期。US8163522保护宿主细胞的培养和产物纯化的方法,该宿主细胞编码相关融合蛋白,从授权日2012年4月24日起算加上17年,这个专利要到2029年4月24日到期。这么一来,这两个专利将Enbrel®在美国的“独占权”延长到了2029年4月。
从1998年首次在美国获批上市,到2029年最后一个重要专利到期,依靠适应症拓展、剂型改进和强大的专利壁垒,原研药企业们试图在长达30年的时间中维持Enbrel®在美国的独占权,从而最大限度地延长该产品的生命周期。我们尝试在下图中总结了涵盖Enbrel®的部分美国专利。

欧洲
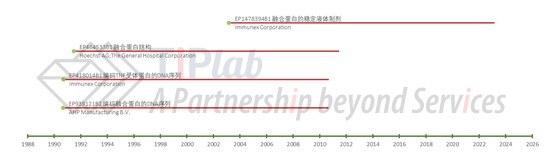
再来看看欧洲的专利申请情况。1990年,Immunex递交了保护依那西普的核心专利申请并获得授权(EP418014),具体保护编码融合蛋白的DNA序列,该欧洲专利后续进入了若干EPC成员国。基于补充保护证书(Supplementary Protection Certificate,SPC),该专利在若干成员国的保护期大都延长至2015年,比如说在英国的保护期延长至2015年7月31日。也就是说,该核心专利已经到期。
在欧洲,另一个比较重要的专利申请是2003年递交的制剂专利(授权专利号:EP1478394),其保护融合蛋白的稳定液体制剂,其中包含L-精氨酸作为聚集抑制剂。不过与同族的美国专利US7648702类似,该专利也没有保护融合蛋白的冻干制剂,使得竞争对手可以通过改变制剂组分或剂型(例如,使用其他聚集抑制剂或使用冻干剂型)来规避这个专利。该专利的保护期至2023年2月27日。
此外,罗氏于1990年申请了保护编码融合蛋白DNA序列的专利并获得授权(EP939121),EP939121与上文提到的两个潜水艇专利的母案US5610279(1993年申请)同族,并要求了共同的优先权。该专利后来转让给了AHP公司,目前属于Pfizer。不过,EP939121已于2015年到期。
仿制药上市前,竞争对手除了要考虑原研药公司的专利情况,还需要全面考虑其它申请人申请的可能造成产品上市障碍的重要专利,这使得针对重要产品进行全面的自由实施分析显得非常关键。比如说Hoechst和The General Hospital Corporation于1991年递交了保护融合蛋白的专利申请并获得了授权(EP464533),具体保护由人TNF受体胞外部分或功能部分和免疫球蛋白的一部分组成的融合蛋白,该专利于2015年到期。
我们在下图中尝试总结了涵盖Enbrel®的部分欧洲专利。
仿制药企业已积极行动
随着围绕依那西普的重要专利陆续到期,仿制药企业已经纷纷递交了上市申请。据悉,三星 Bioepis(与默沙东合作)的依那西普生物类似药Benepali已于2016年1月获欧盟EMA批准上市,是欧洲第一个Enbrel®类似药。Sandoz(山德士,诺华集团非专利药业务部门)的依那西普生物类似药Erelzi于2016年8月在美国获得FDA批准,但由于上文中讨论的两个“潜水艇”美国专利,山德士与安进之间的专利纠纷仍在继续,因此Erelzi还未在美国上市销售。不过这两个专利的有效性日前遭到了挑战,若被成功无效,恐怕会大大减少Enbrel®在美国的销售额(2016年美国销售额约占全球市场的60%)。
实际上,为了扫除仿制药Benepali上市的障碍,山德士早在开始进行临床III期试验时就试图无效安进的US8063182和US8163522两项“潜水艇”专利。山德士认为,专利权人故意拖延以推迟这两项专利的到期期限。不过联邦地区法院以时机不成熟为由驳回了此诉讼,因为当时山德士并没有向FDA递交生物仿制药上市申请,因此双方之间并没有产生真正的争议。联邦巡回上诉法院维持了地区法院的判决,驳回了山德士的诉讼请求。
US8163522的有效性还曾受到过Kyle Bass和经济医药联盟(Coalition for Affordable Medicine)联合提出的双方审查程序(Inter Parties Review,IPR)的挑战,不过专利审判及上诉委员会(PTAB)认为Bass等提供的无效理由不充分,于2016年3月拒绝了其IPR请求。
安进与山德士之间的专利舞蹈正处在第一轮。2016年2月,安进在新泽西联邦地区法院对山德士提起了专利侵权诉讼。诉讼涉及五项专利,包括上文提到的两个“潜水艇”专利和三个保护治疗方法的专利(US7915225、US8119605和US8722631)。安进声称山德士没有遵守BPCIA规定的义务。根据BPCIA的规定,在FDA接受生物类似药申请后20天内,生物类似药企业应当向原研药厂家(reference product sponsor,下文统称RPS)提供生物类似药上市申请(aBLA)副本和描述制造过程的信息,以及可以提供RPS要求的其它信息(42 U.S.C. 262(l)(2))。但山德士并没有提供完整的aBLA副本及制造过程信息。不过,安进随后还是按照BPCIA的规定向山德士提供了用于诉讼和许可的专利清单(42 U.S.C. 262(l)(3)(A))。接着,山德士提供了生物类似药的更多信息,并同意了安进提供的专利清单,声明其将放弃BPCIA赋予的更多权利,并坚持直接由安进在30天内提起诉讼。于是安进就在30天期限的最后一天提出了专利侵权诉讼。最后鹿死谁手,让我们拭目以待。
中国依那西普类似药早已上市
由于原研药企业没有在中国进行专利布局,目前已有3个活性成分为依那西普的药物在中国上市。其中,最早的中信国健生产的益赛普(注射用重组人II型肿瘤坏死因子受体-抗体融合蛋白)于2005年首次获CFDA批准上市,用于治疗类风湿关节炎、强制性脊柱炎及银屑病,属于国家医保目录乙类药物。此外,上海赛金的强克和浙江海正的安佰诺两个TNFα融合蛋白同类产品分别于2011年和2015年上市。不过,早于Enbrel®进入中国市场的益赛普在销售额上占绝对优势,并得益于其已纳入国家医保目录,预期益赛普将会长期保持其市场优势。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
