从肿瘤治疗领域转向眼科疾病领域
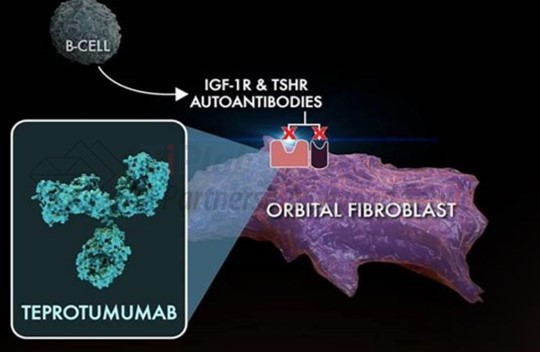
2020年1月,FDA批准Tepezza®(teprotumumab-trbw)用于治疗甲状腺眼病(Thyroid Eye Disease,TED),这是FDA批准的首个治疗甲状腺眼病的药物。TED是一种罕见的自身免疫病,人体攻击其自身过表达IGF-1R的眼眶成纤维细胞,使得眼后的肌肉和脂肪组织发炎,导致眼睛往前推并向外凸出。

Teprotumumab是一种全人源化胰岛素样生长因子1受体(IGF-1R)单抗,通过与IGF-1R结合并阻断其激活和信号转导,减少炎症并阻止细胞的过度生长。
Teprotumumab最初由Genmab和Roche开发用于治疗肿瘤,之后因业务调整中止了对teprotumumab的研发,并将其许可给River Vision Development Corporation用于眼科疾病的研究。2017年,Horizon Therapeutics通过收购River Vision获得了teprotumumab并将其成功推向市场。
Teprotumumab治疗TED获得了FDA授予的突破性疗法、孤儿药资格和快速通道认定。
Teprotumumab这个药研发过程中从治疗肿瘤转向治疗眼科疾病,在治疗领域方面是一个比较大的跨度,且研发的整个历程也比较久,可以预见,这期间会涉及到多个专利申请人递交的不同专利类型,那我们讨论下围绕teprotumumab的部分专利家族的情况如何。
根据Horizon Therapeutics披露的内容来看,teprotumumab的专利资产大部分是通过许可的方式获得的,包括:Roche、Lundquist Institute (formerly known as Los Angeles Biomedical Research Institute at Harbor-UCLA Medical Center)和Boehringer Ingelheim等。我们主要讨论Roche和Lundquist Institute的相关专利家族。
Roche递交的抗体活性成分家族
Teprotumumab活性成分家族—PCT/EP2004/007562
Roche在2004年以EP03015526.1作为优先权,递交了PCT/EP2004/007562,主要保护生产结合IGF-1R抗体的方法和抗体的序列,从说明书的描述来看,当时开发IGF-1R抗体的主要目的是用于治疗肿瘤。
同族授权的中国专利为ZL200480019796.X,权利要求1如下:
“1.一种结合IGF-IR并且抑制IGF-I和IGF-II与IGF-IR结合的抗体,其特征在于所述抗体
a)是IgG1同种型,
b)显示其对IGF-I与IGF-IR结合的抑制的IC50值与其对IGF-II与IGF-IR结合的抑制的IC50值的比率为1∶3-3∶1,
c)当与没有所述抗体的这种测定比较时,在含0.5%的热灭活胎牛血清(FCS)的培养基中,使用HT 29细胞的细胞磷酸化测定中,其在5nM的浓度上抑制至少80%的IGF-IR磷酸化,和
d)当与没有所述抗体的这种测定相比,在含0.5%的热灭活胎牛血清(FCS)的培养基中,使用3T3细胞的细胞磷酸化测定中,其在10μM的浓度上没有显示作为IGF-IR磷酸化所测量的IGF-IR刺激活性,所述3T3细胞提供400,000-600,000分子IGF-IR/细胞,
e)包含抗体重链,所述抗体重链包含作为CDRs的SEQ ID NO:1或3的位于31-35位置的氨基酸组成的CDR1,位于50-66位置的氨基酸组成的CDR2和位于99-107位置的氨基酸组成的CDR3,
f)包含抗体轻链,所述抗体轻链包含作为CDRs的SEQ ID NO:2或4的位于24-34位置的氨基酸组成的CDR1,位于50-56位置的氨基酸组成的CDR2和位于89-98位置的氨基酸组成的CDR3。”
可见,其权利要求1保护一种抗体,对抗体的限定包括:重链和轻链的CDR序列以及功能性的限定,其限定的序列涵盖teprotumumab。
同族US7579157B2保护一种选择没有IGF-IR刺激活性的抗IGF-IR的抗体的方法,通过测量存在和不存在抗体的情况下细胞的PKB磷酸化水平来选择抗体。
US7579157B2的分案US7572897B2则保护抗体的活性成分,从权利要求的限定来看,其保护了两组抗体的CDR序列,分别是SEQ ID NO:1、SEQ ID NO:2和SEQ ID NO:3、SEQ ID NO:4。
Teprotumumab变体活性成分家族—PCT/EP2011/060376
2010年,Roche还递交了另外一个涉及IGF-1R抗体的PCT/EP2011/060376,该PCT申请未进入任何国家阶段,从递交的日期来看,应该也不会进入任何国家阶段了。
换句话说,PCT/EP2011/060376权利要求中的技术方案没有在任何国家/地域获得保护,因此,如果IGF-1R抗体的序列落入权利要求的范围中则不会有侵权的问题,但该申请中公开的序列已经成为现有技术,这意味着别人也将无法保护该申请中公开的抗体序列(新颖性问题)。
PCT/EP2011/060376的权利要求1中限定了IGF-1R抗体的CDRH3序列为在SEQ ID NO: 1(即teprotumumab的CDRH3序列)的基础上具有一个点突变,也就是说该权利要求涉及的是teprotumumab变体的序列,能够在一定程度上防止竞争者通过对序列进行小的改动来开发IGF-1R抗体,权利要求1如下:
“1. An isolated antibody specifically binding to human IGF-1R, characterized in comprising as heavy chain variable domain CDRH3 region a CDRH3 region of SEQ ID NO: 1 with a mutation selected from the group consisting of E1Q, L2E, L2F, L2H, L2M, L2T, G3K, G3L, G3Q, R4H, R4K, Y6F, Y6H, Y6W, D8A, D8G, D8Q, D8S, L9G, L9I, L9N, L9P, L9Q, L9R, L9T, or L9V.”
Lundquist递交的医药用途家族—PCT/US2003/000187
从专利申请的内容上看,Lundquist(主要参与teprotumumab临床试验)最早发现了IGF-1R特异性阻断抗体可以减轻格雷夫斯病这一治疗机理。
Lundquist首先在2001年递交了涉及在患者中检测甲状腺相关性眼病的方法(US6936426B2),其部分延续案US7998681B2涉及一种检测患者格雷夫斯病的方法。
US7998681B2的部分延续案US8153121B2涉及宽泛的使用IGF-1R特异性阻断抗体减轻格雷夫斯病(Graves’ disease,GD)的严重性的方法,没有限定抗体的具体序列,其从属权利要求限定GD可以是Thyroid-associated ophthalmology (TAO,又称TED) ,即,US8153121B2涵盖IGF-1R抗体治疗TED的治疗机理,只要利用此机理治疗TED都会落入该专利的保护范围。
“1. A method of reducing the severity of Graves’ disease (GD) comprising administering an effective amount of a blocking antibody specific for Insulin Like Growth Factor-1 Receptor (IGF-1R) to an individual, wherein said blocking antibody binds to a receptor subunit of the IGF-1R, and wherein said blocking antibody inhibits activation of fibroblasts caused by interaction between IGF-1R and an endogenous immunoglobulin.”
之后Lundquist要求US7998681B2和US7998681B2的优先权,递交了PCT/US2003/000187,随后进入EP并获得授权(EP1469879B1),同样保护宽泛的治疗机理。
Teprotumumab的专利资产构成
Teprotumumab在开发过程中几经转手,且涉及到领域转变,其专利保护的情况会比较复杂,这期间通常会涉及到多个申请人递交的不同专利家族,且可能会经历多次专利许可或转让,对于其它竞争者来说,这会给自由实施分析造成一定的困扰。
因此,我们在分析teprotumumab的专利资产时需要考虑研发过程中可能涉及的不同申请人,以保证不会遗漏任何可能的风险。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
