Sutent适应症申请扩展
Sutent®(索坦®,通用名:sunitinib/舒尼替尼,SU11248)是一种口服的酪氨酸激酶抑制剂。
Sutent®能抑制多种受体酪氨酸激酶,涉及肿瘤生长、病理性血管生成和癌症转移的过程。其靶点包括血小板衍生生长因子受体(PDGFR)、血管内皮生长因子受体(VEGFR)、干细胞因子受体(KIT)、fms样酪氨酸激酶受体3(FLT3)、集落刺激因子受体类型1(CSF-1R)和神经胶质细胞系衍生神经营养因子受体(RET)。
Sutent®通过阻断为肿瘤生长供应血液和营养物质的血管生成,来杀死肿瘤细胞。
2006年1月,Sutent®首次获批用于治疗晚期肾细胞癌(RCC)和罕见的胃肠道间质瘤(GIST),这是FDA首次批准能同时治疗两种疾病的抗癌药物。此前,该药已被FDA认定为“显著超越现有疗法”而被授予快速通道审批资格。2011年5月,Sutent®获准用于治疗罕见胰腺神经内分泌瘤(pNET)。2017年11月,FDA批准Sutent®用于辅助治疗肾脏切除术后的高危复发性肾细胞癌成年患者,成为第一个获批用于该病症患者辅助治疗的药物。Sunitinib持续在肾细胞癌的治疗上展现出令人鼓舞的结果,可以说是肾癌靶向疗法的一个里程碑。
Sutent®上市十几年来,已被多个国家和地区的医学指南推荐作为晚期肾细胞癌的一线标准治疗药物。从2010年起,已经连续8年为辉瑞带来超过10亿美元年销售额的业绩。
Sutent活性成分
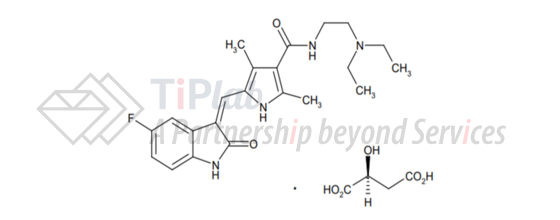
Sutent®有效成分为苹果酸舒尼替尼(sunitinib malate)。Sunitinib malate的分子式为C22H27FN4O2·C4H6O5,分子量为532.6 Dalton。化学结构如下:
Sutent制剂
FDA批准的Sutent®制剂包含12.5 mg,25 mg,37.5 mg和50 mg共四种规格的硬胶囊,辅料包含甘露醇、交联羧甲基纤维素钠、聚维酮(K-25)和硬脂酸镁这些无活性的成分。内容物为黄色至橙色的颗粒。
围绕Sutent的专利申请
活性成分专利家族
Sunitinib最初由Sugen公司(被Pharmacia收购,后者又被辉瑞公司收购)研发,2001年2月,Sugen于同一日递交了涉及活性成分的美国专利申请(授权公告号:US6573293B2)和PCT专利(PCT/US2001/04813),要求了三个美国申请的优先权。PCT/US2001/04813进入了包括US、EP、JP、CN等多个国家或地区。
US6573293B2的权利要求1涉及通式如下的化合物或其药学上可接受的盐:
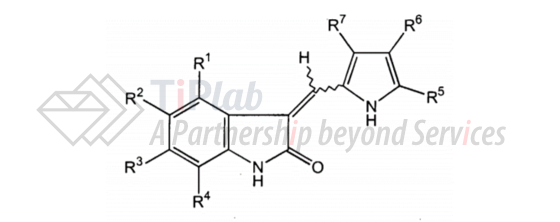
并限定了多个取代基,保护范围涵盖sunitinib。US6573293B2的独立权利要求24还涉及使用包含权利要求1的药物组合物来治疗蛋白激酶相关病症的方法。
PCT/US2001/04813进入中国国家阶段的授权专利为CN1329390C。
与其同族的美国授权专利相比,CN1329390C也涉及了相同通式的化合物或其可药用的盐,但是对基团的限定范围较其同族的US6573293B2更小些。
以US6573293B2为母案,Sugen递交了多个延续申请或分案申请,涉及活性成分或其组合物,比如: 延续案US7125905B2则涉及包含了sunitinib的化合物或其组合物。延续案US7572924B2则涉及sunitinib的变体。
US6573293B2和US7125905B2均将于2021年2月到期,加上儿科用药6个月的市场保护期,Sutent®的独占期将延长至2021年8月。
治疗用途专利家族
2000年12月,Sugen于同一天递交了美国专利申请(US09/741,842)和PCT专利申请(PCT/US2000/035009),涉及治疗或预防与c-kit激酶介导的信号转导途径有关的异常病症的方法。
PCT/US2000/035009已经进入了EP和JP等国家,但并未进入中国。
US09/741,842未获得授权,其延续案之一US11/205,474获得了授权(授权公告号:US7211600B2)。
US7211600B2的独立权利要求1涉及使用sunitinib治疗与c-kit激酶介导的信号转导途径中的畸变有关的异常病症的方法,并且限定了该异常病症为一种或多种胃肠道间质瘤。其它独立权利要求还分别涉及使用sunitinib治疗c-kit激酶活性相关病症——肥大细胞增生症、过敏性相关的慢性鼻炎、炎症或哮喘和肥大细胞肿瘤的方法。
US7211600B2将于2020年12月到期,加上儿科用药6个月的市场保护期,Sutent®的独占期将延长至2021年6月。
独占期助力专利保护
为了鼓励新药研发,FDA还设置了市场独占期保护:对新化学实体、外加的临床研究、孤儿药和儿科用药分别给予5年、3年、7年和6个月保护期。其中儿科独占期可以在现有的专利和市场独占期基础上增加6个月。
2017年,辉瑞通过拓展新的适应症——辅助治疗肾脏切除术后的高危复发性肾细胞癌,额外获得了3年的新临床研究独占期,加上6个月的儿科独占期,其市场独占期可延长3.5年至2021年5月,以阻止FDA在此期间内批准依赖于该临床研究信息的ANDA或第505(b)(2)条申请。
RCC领域竞争十分激烈,虽然Sutent®作为一线药物具有首选地位,其它治疗方案也接踵而至,如诺华的Afinitor®、罗氏的Avastin®和葛兰素史克的Votrient®从2007年开始都已进入RCC市场。专利保护则帮助辉瑞保持其市场竞争优势。
除了同类产品的竞争之外,Sutent®还面临着仿制药的竞争。舒尼替尼化合物专利将于2021年到期,一旦专利保护到期,其市场即将面临仿制药的瓜分。
与生物类似药相比,化学仿制药对品牌药的冲击是灾难性的,目前国内该品种的申报企业至少有11家。其包括儿科独占期和临床研究独占期的市场独占期以及专利保护期一同为辉瑞应对Sutent®仿制药的竞争增加了缓冲带。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
