白血病靶向药-Tibsovo®
Tibsovo®(ivosidenib,艾伏尼布,又名AG-120)由Agios Pharmaceuticals(以下简称“Agios”)进行研发和全球推广。2018年7月,该药获美国食品药品管理局(FDA)批准,用于治疗经Abbott RealTimeTM IDH-1伴随诊断试剂盒证实存在异柠檬酸脱氢酶-1(IDH-1)突变的复发性/难治性急性髓系白血病(R/R AML)成人患者。
2019年8月,该药的适应症获FDA批准扩大到一线治疗年龄≥75岁或因为其它合并症无法使用强化化疗的新诊断AML成人患者。
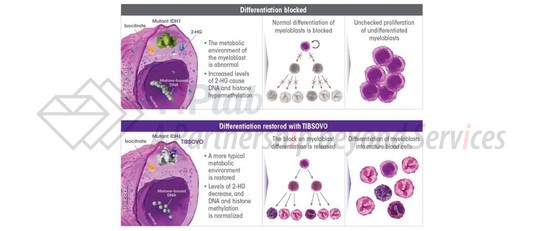
据统计,约有6%~10%的AML患者存在IDH-1突变,突变的IDH蛋白可将α-酮戊二酸(α-KG)还原成2-羟基戊二酸(2-HG),异常产生的2-HG可促进肿瘤发生。
Tibsovo®主要通过抑制代谢物2-HG的产生,从而逆转细胞分化的阻滞、诱使肿瘤母细胞分化为正常功能的细胞。
Tibsovo®活性成分
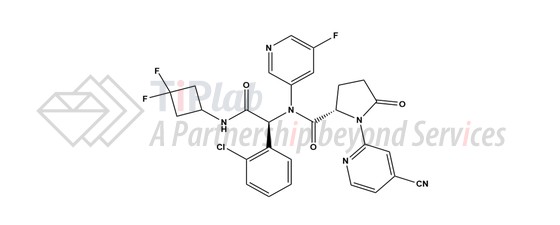
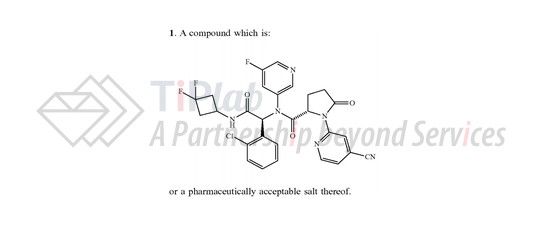
Ivosidenib的分子式为C28H22ClF3N6O3,相对分子量为583.0 Dalton。化学名称为 (2S)-N-{(1S)-1-(2-氯苯基)-2-[(3,3-二氟环丁基)-氨基]-2-氧代乙基}-1-(4-氰基吡啶-2-基)-N-(5-氟吡啶-3-基)-5-氧吡咯烷-2-羧酰胺。化学结构如下:
Tibsovo®制剂
Tibsovo®以薄膜包衣片口服给药,片剂规格为250 mg。
片剂的非活性成分:胶体二氧化硅,交联羧甲基纤维素钠,醋酸羟丙甲纤维素琥珀酸酯,硬脂酸镁,微晶纤维素和十二烷基硫酸钠。Agios在相关的专利申请中涉及到了该制剂配方。
片剂包衣成分:FD&C蓝色#2,羟丙基甲基纤维素,乳糖一水合物,二氧化钛和三醋精。
“基础专利+次级专利”组合策略,构建Tibsovo®专利壁垒
通过构建“基础专利+次级专利”组合的方式,Agios沿技术分支和产品开发时序对Tibsovo®进行专利布局,以累叠专利有效期、延长产品保护、拖延竞争对手的进入、维护垄断利润。
精准拆分基础专利,增强活性成分保护力度
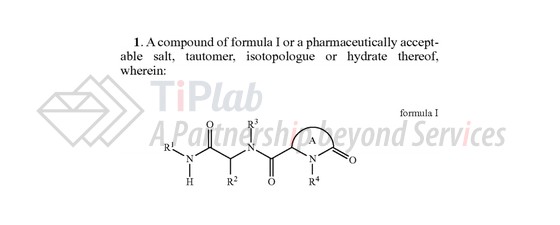
2013年1月,Agios递交了涉及Ivosidenib活性成分的美国专利申请US13/745,005,其权利要求1涉及一种通式化合物或其药学上可接受的盐、互变异构体、同位素或水合物,并对该通式化合物的取代基进行了马库什限定。
该基础专利申请于2016年10月获得授权,其授权专利号为US9474779B2。US9474779B2的专利调整时间为213天,预计将于2033年8月到期。
对于基础专利,Agios的布局策略是将活性成分本身的保护拆分成多个申请文件进行保护。
以US9474779B2为母案,Agios先后递交了多篇延续案,且延续案与母案的保护范围不均相同,其中授权延续案US9850277B2的权利要求1只涉及Ivosidenib的活性成分或其药学上可接受的盐。权利要求1如下:
“在一份申请中涵盖多种化合物,同时在另一份申请中只包含特定的一个化合物”,即“宽泛”与“精准”相结合,是基础专利布局的常用策略。Agios结合自身的研发进度,分别针对通式结构(涵盖活性成分)与具体活性成分结构提交了基础专利申请,加强了活性成分保护力度,在保护自身创新技术的同时抵制了竞争对手的攻击。
多层次次级专利,助力原研企业抢占市场
除了活性成分的基础专利,Agios还对Ivosidenib的次级专利进行了布局,通过次级专利保护活性化合物的晶型、制剂、用途等方面。此次布局Agios以一份涉及Ivosidenib用途的PCT申请为基础,进行了多层次拆分,具体如下:

2015年3月,Agios递交了涉及Ivosidenib次级专利的PCT专利申请(PCT/US2015/020349),PCT/US2015/020349进入了包括US、EP、JP、CN等多个国家或地域。
PCT进入美国国家阶段的授权专利US9968595B2,其权利要求涉及Ivosidenib活性成分的两种晶型。

US9968595B2的美国延续申请US10449184B2,其权利要求涉及一种口服给药的药物组合物,其包含固体分散体和一种或多种药学上可接受的载体。其中固体分散体包含Ivosidenib活性成分或其药学上可接受的盐以及限定的聚合物。该专利保护剂型涵盖FDA获批剂型。权利要求1如下:

Agios布局多层次的次级专利家族,以保护Ivosidenib活性成分的晶型、制剂、用途等,覆盖药物的多个方面。多层次的次级专利布局,在面对仿制药企业挑战基础专利的有效性时,也将有助原研推广及维持市场份额,成为打击竞争对手的有效“武器”。
次级专利增加仿制难度
对于仿制药企业来说,次级专利增加了判断产品专利到期的难度,在进入相关市场时对于潜在的侵权行为有所顾忌。时常出现的一种情况,当仿制药企业明确活性成分基础专利已经到期后,想要采取某种更经济的方法生产该化合物或者使用更稳定的晶型时,又发现落入原研企业次级专利的保护范围内。
这就是我们时常提到的,核心基础专利到期,不等于与药品有关的所有专利都到期,仿制仍然可能存在侵权风险。在仿制药立项阶段或研究取得阶段性成果时,仿制药企业可提前对原研药的所有相关专利申请进行侵权风险分析,跟踪可能带来风险的专利申请的法律状态,以合理安排研发和商业化进程。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
