什么是HPV疫苗?
HPV全称是人乳头状瘤病毒,是导致宫颈癌的主要诱因。目前,已有两家企业的HPV疫苗获得CFDA的批准,分别是葛兰素史克 (GSK)的希瑞适® (Cervarix®)和默沙东 (MSD)的佳达修® (Gardasil®)。这两种疫苗都包含HPV-L1蛋白形成的病毒样颗粒 (VLPs)。
GSK的希瑞适® (Cervarix®)率先于2016年获得批准,并于2017年7月正式上市。希瑞适®的活性成分为人乳头瘤病毒16型L1蛋白和人乳头瘤病毒18型L1蛋白 (俗称二价疫苗),L1蛋白经纯化后组装形成病毒样颗粒。可以预防由HPV-16和HPV-18引起的宫颈癌,接近70%的宫颈癌都是由这两种病毒亚型引起的。时隔一年不到,MSD的佳达修® (Gardasil®)也获得了CFDA的批准。佳达修®在希瑞适®的基础上增加了两个病毒亚型—HPV-6型和HPV-11型 (俗称四价疫苗),能够预防的疾病种类更多,但目前还未正式上市销售。
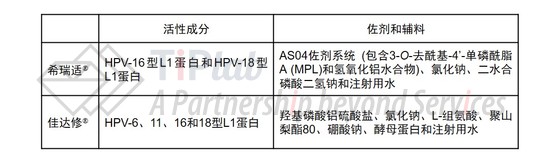
此外,MSD在2014年还在美国推出了九价疫苗佳达修®9 (Gardasil®9),在原有四价疫苗的基础上又新增了31、33、45、52和58五种HPV亚型。2016年,佳达修®和佳达修®9在全球的销售额已经达到了21.7亿美元。
GSK和MSD都不惜经历漫长的审批过程,希望能够从中国这个巨大的市场中获得可观的收益。让我们来看看他们各自为潜在的竞争对手构筑了哪些壁垒。
GSK在中国的专利武器
在中国,GSK获得了一系列保护疫苗或其组合物的专利,比如,2007年获得授权的CN1325117C涉及对希瑞适®的保护。
CN1325117C的权利要求1保护:
“一种疫苗,所述疫苗包含人乳头瘤病毒16 L1病毒样颗粒,人乳头瘤病毒18 L1病毒样颗粒,氢氧化铝和3脱-O-酰化单磷酰基脂质A。”
其中,“氢氧化铝和3脱-O-酰化单磷酰基脂质A”为希瑞适®产品说明书中描述的AS04佐剂系统。CN1325117C的保护期预计可至2020年9月。
CN100528226C是另一个保护疫苗组合物的代表性专利,于2009年获得授权。
CN100528226C的权利要求1保护:
“一种包含VLPs的疫苗组合物,其中VLPs包含来源于HPV 16、HPV 18、HPV 31和HPV 45基因型的L1蛋白或功能性的L1蛋白衍生物,其中由疫苗产生的免疫应答处于仍然能观察到每一VLP类型的保护性效果的水平上。”
从其权利要求的字面描述来看,要求包含来源于HPV 16、HPV 18、HPV 31和HPV 45基因型的L1蛋白或功能性的L1蛋白衍生物。该专利的保护期预计到2023年3月。
制备由HPV-16型L1蛋白和HPV-18型L1蛋白组成的免疫组合物并不落在该权利要求的范围内,也就是说,CN100528226C可能并不保护希瑞适®这种二价疫苗。但CN100528226C可能涵盖了MSD的九价疫苗佳达修®9,因为佳达修®9具备“包含来源于HPV 16、HPV 18、HPV 31和HPV 45基因型的L1蛋白”这一特征。当然,权利要求的保护范围还需要综合考虑说明书的内容和审查历史综合判断。
另外,GSK还拥有一个组合物专利CN1976718B,其于2012年获得授权。
CN1976718B的权利要求1保护:
“免疫原性组合物,包含来自HPV 16和18和至少一种其它HPV癌症类型的VLP或病毒壳微体,其它癌症类型选自HPV类型31、45和52,其中至少一种其它癌症类型的VLP或病毒壳微体的剂量少于HPV 16或18的剂量。”
可见,CN1976718B限定免疫原性组合物中包含HPV 16和18,并且还包含至少一种其它HPV癌症类型的VLP或病毒壳微体,其它癌症类型选自31、45和52。因此,制备由HPV 16和18型 L1蛋白组成的二价疫苗 (例如,希瑞适®)可能不会落在CN1976718B的范围内。MSD的四价疫苗佳达修®不包含选自“31、45和52”的“其它HPV癌症类型的VLP”,因此CN1976718B也没有涵盖MSD的四价疫苗佳达修®。此外,CN1976718B的权利要求1还限定了“至少一种选自31、45和52的其它HPV类型VLP”的剂量少于“HPV 16或18的剂量”,可见还需要考虑VLP或病毒壳微体的剂量信息来判断其保护范围。CN1976718B同样来自于一个PCT专利,其保护期可至2025年6月。
MSD在中国的专利武器
MSD在HPV疫苗领域布局的一个代表性的中国专利申请CN1173203A的权利要求1涉及:
- “分离和纯化的乳头状瘤病毒衣壳蛋白,所述衣壳蛋白选自L1蛋白、L2蛋白、L1+L2蛋白,和其官能衍生物,所述蛋白至少70%纯度”。不过,CN1173203A最终并没有获得授权 (视撤)。
MSD也拥有一些授权的中国专利,比如:CN1934131B。
CN1934131B的权利要求1保护:
“一种核酸分子,其由如SEQ ID NO:1所示的核苷酸序列组成,其中已针对在酵母细胞中高表达对所述核酸序列进行了密码子优化”。
权利要求1中提到的SEQ ID NO:1是编码HPV-52 L1蛋白的核苷酸序列。进行密码子优化是为了提高蛋白的表达水平,从而降低生产成本。CN1934131B限定了具体的核苷酸序列,其专利保护期预计至2025年。因为希瑞适®和佳达修®均不涉及HPV-52 L1蛋白,因此CN1934131B的保护范围并不涵盖希瑞适®和佳达修®。
另一个代表性中国专利是CN100506999C,于2009年获得授权。
CN100506999C的权利要求1保护:
“核酸分子,其由编码SEQ ID NO:4中提出的HPV31 L1蛋白质的核苷酸序列组成,所述核苷酸序列经密码子优化以在酵母细胞中高水平表达。”
CN100506999C保护编码一种蛋白质的核酸分子,限定了该核酸分子编码的HPV31 L1蛋白的具体氨基酸序列,而没有直接限定该核苷酸序列本身。CN100506999C预计将在2024年3月到期。
另辟蹊径,冲出重围
有趣的是,虽然MSD和GSK在HPV疫苗中是一对竞争对手,但他们双方却达成了专利交叉许可,避免了没完没了的专利战,还可以强强联手一致对外,从而基本上垄断了HPV疫苗市场。竞争对手除了需要避开专利侵权的问题之外,还可能需要另辟蹊径。我们知道,昂贵的价格是HPV疫苗进行产品推广的一大硬伤,这源于其较高的生产成本,如果可以想办法降低疫苗的生产成本则将是一大竞争优势,尤其是针对中国市场。此外,希瑞适®和佳达修®都要分三次注射,这降低了疫苗的接种率,从美国市场来看,只需要注射两次的佳达修®9更受欢迎,因此,如果能改善疫苗的接种方式或接种次数也不失为一种策略。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
