可编程的基因编辑技术CRISPR-Cas9及其研究历程
CRISPR为常间回文重复序列丛集关联蛋白系统,是一种源自细菌及古细菌的获得性免疫系统。某些细菌在遭到病毒入侵后,能够把病毒基因的一小段存储到自身DNA中的存储空间——CRISPR。当再次遇到病毒入侵时,细菌能够根据存储的片段识别病毒,将病毒的DNA切断而使其失效。
2011年法国女科学家Emmanuelle Charpentier发表了关于CRISPR研究的文章,之后美国加州大学的Jennifer Doudna与Emmanuelle展开合作,于2012年6月发表了重要研究论文(Jinek et al., 2012)。该论文确定了CRISPR-Cas9系统中Cas9、crRNA和tracrRNA的功能,但没有记载任何在细胞内进行的实验。
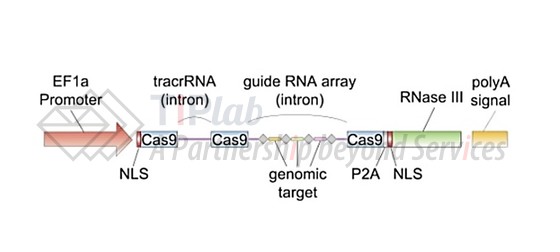
Broad研究所的张锋在2012年1月向NIH申请了关于运用CRISPR-Cas9系统对真核细胞进行基因编辑的研究项目(主要思路如下图所示)。张锋的小组在2013年2月发表了论文,首次将CRISPR-Cas9成功用于真核细胞的基因编辑。
CRISPR在美国的专利之争
CRISPR专利之争就集中爆发在上述两大牛人阵营中,一方是加州大学的Jennifer与Emmanuelle,其核心专利申请为US 13/842859(申请日为2013年3月15日,优先权日2012年5月25日,以下简称专利申请’859)。专利申请’859的权利要求165如下所示: 
该专利申请并没有指明上述方法对应的特定的细胞种类或环境,也没有在说明书中记载任何关于在真核细胞中使用CRISPR-Cas9系统的内容。
另一方是Broad研究所的张锋,其核心专利为US 8697359(申请日为2013年10月15日,优先权日为2012年12月12日,该专利在申请阶段使用加快审查程序,早于专利申请’859获得专利权,以下简称专利’359)。专利’359的权利要求1如下所示。
1.A method of altering expression of at least one gene product comprising introducing into a eukaryotic cell containing and expressing a DNA molecule having a target sequence and encoding the gene product an engineered, non-naturally occurring Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR)—CRISPR associated (Cas) (CRISPR-Cas) system comprising one or more vectors comprising:
a)a first regulatory element operable in a eukaryotic cell operably linked to at least one nucleotide sequence encoding a CRISPR-Cas system guide RNA that hybridizes with the target sequence, and
b)a second regulatory element operable in a eukaryotic cell operably linked to a nucleotide sequence encoding a Type-II Cas9 protein,
wherein components (a) and (b) are located on same or different vectors of the system, whereby the guide RNA targets the target sequence and the Cas9 protein cleaves the DNA molecule, whereby expression of the at least one gene product is altered; and, wherein the Cas9 protein and the guide RNA do not naturally occur together.
可见,专利’359所述的方法可以适用于真核细胞。
在抵触程序(interference)中,Broad研究所认为,专利’359中的权利要求与专利申请’859中的权利要求在可专利性上存在显著的不同。理由是本领域技术人员并不能合理地预期CRISPR-Cas9系统能够在真核细胞中成功地发挥作用。对此,加州大学表示不服并开始上诉。
抵触程序
抵触程序是指是美国专利商标局用来决定谁先发明的程序。申请人可依照37 C.F.R. § 1.607的要求请求启动抵触程序,指明自己的专利申请中哪些权利要求和另一申请或已授权专利中的哪些权利要求涉及同样的发明。
先发明制
美国专利申请从2013年3月16日起(AIA)由先发明制改为发明人先申请制。先发明制简单而言为专利授予最先做出发明创造的人。专利’359和专利申请’859均适用于pre-AIA,即先发明制。张锋曾通过提供他的实验室笔记本的快照,表明他在2012年年初就建立并运行了CRISPR-Cas系统。
具体而言,Broad研究所认为本领域技术人员并不能合理地预期CRISPR-Cas9系统能够在真核细胞中成功地发挥作用,他们列出了以下几个方面的理由:
1、Broad研究所提供的专家证人Dr. Paul Simons证明,原核细胞系统和真核细胞系统之间存在的差异使得CRISPR-Cas9系统在真核细胞中的应用是难以预料的。Simons博士认为在不同的细胞条件下,蛋白质的折叠方式不同,而Cas9蛋白的折叠方式会直接影响其构象的改变,从而影响CRISPR-Cas9系统发挥作用。在真核细胞和原核细胞中,不同离子的浓度、pH等因素都不同,它们都属于上述“不同的细胞条件”。
2、只有真核细胞具备能够剪切RNA分子的核糖体核酸,同时,真核细胞还存在降解双链RNA的机制。由于CRISPR-Cas9系统必须借助crRNA、tracrRNA以及crRNA与tracrRNA结合形成的双链RNA,因此本领域技术人员会认为CRISPR-Cas9系统在真核细胞中岌岌可危,很难起效。
3、与细菌简单的基因组相比,人类基因组太大了,其中具备相似DNA序列的概率也增大了。 同时,Broad研究所还提供了加州大学的发明人自己承认在真核细胞中使用CRISPR-Cas9系统存在很多不确定性的证据,包括那些“让人失望的”试验结果。例如,Jennifer承认她在动物和人类细胞中使用CRISPR-Cas9系统遇到了“巨大的瓶颈”,同时她承认Broad研究所实现了这一效果是“一个复杂的发现”。
加州大学对此进行了反驳,其主要理由是在2012年Jennifer与Emmanuelle发表论文后,有6个研究小组相继在很短的时间内将CRISPR-Cas9系统应用于真核细胞中,可见对本领域技术人员而言,他们有动机将CRISPR-Cas9系统应用于真核细胞。
然而,CAFC认为加州大学的理由并不具备说服力。
反之,CAFC认为Broad研究所的理由比较详实有说服力,同时认为专利’359和专利申请’859的权利要求的保护范围在可专利性上是不同的(patentably distinct),两者并不存在冲突,因此对PTAB的裁定维持原判。
同时CAFC声明,该决定并不涉及专利’359和专利申请’859的权利要求本身是否有可专利性。因此,双方很可能还会展开一系列法律纠纷。
后续影响之风云再起
CAFC的这个裁定对Broad研究所非常有利,Editas Medicine作为一家由张锋创办的基因编辑初创公司,其股价自本裁定后大涨。同时,Editas Medicine CEO兼董事长Katrine Bosley表示本裁定“重申了我们知识产权基础的优势,并对生产CRISPR药物具有深远的意义”。
加州大学则大概率会不满本次裁定的结果而进行上诉。Emmanuelle创立的Crispr Therapeutics AG,以及被许可使用加州大学技术的Intellia Therapeutics公司的股价已在本次裁定发布后下跌,它们也很可能会积极参与到该纠纷中。
而在欧洲,加州大学方的相关专利则已经获得了授权(EP2800811B1和EP3241902B1);Broad研究所的申请EP 2771468B1因缺乏新颖性等原因而被EPO撤销。可见Broad研究所和加州大学之间的专利纠纷仍未终止,双方最终仍有可能以交叉许可的方式进行和解。
与此同时,随着CRISPR-Cas9系统的广泛应用,这一领域的专利申请越来越多,每个申请人最终很可能只拥有该系统中非常少的一部分知识产权。一些非盈利机构,例如Biobricks基金会准备为CRISPR-Cas9系统作为共享的生物技术而提供法律框架支持,以期广大的科研人员能够在未来共享这一技术。然而,这一目标应该还需要很久的时间才有实现的可能性。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
